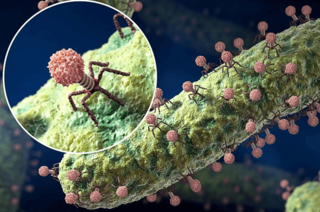
Бактериофаги — вирусы, которые способны заражать бактерии
Одним из самых серьезных шагов в развитии современной медицине стало открытие антибиотиков. Многие болезни, которые ранее считались смертельными, с этого момента начали легко поддаваться лечению. Это позволило повысить среднюю продолжительность жизни на 23 года. Но, к сожалению, спустя чуть менее 100 лет с момента открытия пенициллина, человечество оказалось перед угрозой вернуться в те времена, когда антибиотиков не существовало. Сами препараты, конечно, никуда не исчезнут, но они будут совершенно неэффективными, так как бактерии становятся устойчивыми к ним. Решением проблемы может стать новый класс антибиотиков, однако они не появляются уже с 80-х годов. По мнению некоторых ученых, единственным правильным решением в такой ситуации является разработка препаратов, которые смогут заменить антибиотики. Фактически такие препараты существуют и даже уже применяются в медицине.
Почему антибиотики становятся неэффективнымиАнтибиотики стали краеугольным камнем современной медицины. С одной стороны, они позволили решить многие проблемы. Однако вместе с ними стали появляться болезнетворные бактерии, которые способны уклонения от антибиотиков. Это явление называется устойчивостью к противомикробным препаратам, или УПП.
Всемирная организация здравоохранения называет УПП одной из самых серьезных угроз для здоровья человечества. По оценкам ученых, в 2019 году устойчивые к лекарствам бактерии стали причиной более миллиона смертей. То есть, антибиотикорезистентность стала одной из главных причин смертности в мире.
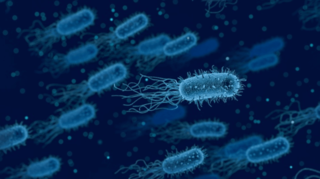
Супербактерии каждый год убивают больше людей, чем СПИД и малярия
Но постоянно снижающаяся эффективность антибиотиков не является из единственным минусом. Многие исследования показывают, что они становятся причиной различных проблем со здоровьем. В частности, из-за них люди становятся аллергиками. Иногда антибиотики вызывают даже галлюцинации или проблемы с мышлением. К этому следует добавить уничтожение микрофлоры кишечника и ряд других побочных действий.
Бактерии, которые резистентны к антибиотикам, называются супербактериями. По мнению ученых, пандемия коронавируса спровоцировала еще больший рост таких бактерий во всем мире. Однако, справедливости ради следует отметить, что супербактерии существовали на земле еще за долго до того, как люди стали применять антибиотики в медицине, о чем мы рассказывали ранее.
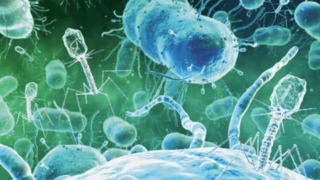
Фаготерапия эффективна даже против тех бактерий, которые невозможно уничтожить антибиотиками
Что такое фаготерапияФаготерапия — это метод лечения бактериальных инфекций при помощи вирусов, которые заражают бактерии и впоследствии их убивают. Такие вирусы принято называть бактериофагами. Фаги заражают бактерии, связываясь с одним или несколькими рецепторами на поверхности клетки. В результате фаготерапия показывает эффективность даже при лечении таких инфекционных болезней, против которых бессильны антибиотики.
Несмотря на то, что фаговая терапия еще до конца не изучена, она применяется уже давно. Несколько лет назад мы рассказывали, что на основе бактериофагов создаются препараты. Но на самом деле фаготерапию стали использовать в медицине еще раньше. К примеру, она получила широкое распространение в СССР, где изучение бактериофагов началось еще в середине 30-х годов прошлого века. Надо сказать, что фаготерапия и по сей день применяется в странах СНГ, включая Россию. Также в последнее время проводятся ее клинические испытания и даже применение в США и Европе.

Бактериофаги, в отличие от антибиотиков, не влияют на микрофлору кишечника
Преимущества и недостатки фаготерапииОткрытие фагов является относительно быстрым и недорогим способом создания препаратов против инфекций. Как сообщают эксперты, в отличие от традиционных фармацевтических исследований, фаготерапия, для ее развития, требует только базового лабораторного оборудования и навыков. Для создания же нового антибиотика, по оценкам специалистов, понадобится от 10 до 15 лет и не менее миллиарда долларов США.
По сути, чтобы создать препарат против тех или иных бактерий, нужно лишь найти фаг, который способен их заражать. Дело в том, что бактериофаги очень «узконаправленные». С одной стороны, в этом их плюс. Они не способны причинять вред полезным бактериям, в отличие от антибиотиков. Но, с другой стороны, для лечения каждой болезни придется использовать определенный тип микрофагов. Антибиотики же, как известно, имеют более широкий спектр действий.
Но зато, благодаря низкой стоимости и простоты изготовления препаратов на основе микрофагов, лекарственные средства могут стать более доступными. В том числе препаратами против бактерий можно полностью обеспечить развивающиеся страны Африки, которые в настоящее время зачастую не имеют доступ даже к самым простым антибиотикам.

Бактериофаги живут там, где есть бактерии, к примеру, в сточных водах
Где ученые находят бактериофагиСамая интересная особенность бактериофагов заключается в том, что они живут там же, где и сами бактерии, что логично, так как для размножения бактериофагам нужны бактерии. К примеру, сотрудники Кенийского медицинского исследовательского института обнаружили фаги, способные уничтожать лекарственно устойчивые бактерии Klebsiella pneumonia и Pseudomonas aeruginosa, в сточных водах городской канализации. То есть там же, где живут и сами эти бактерии. В настоящее время команде удалось обнаружить уже более 150 фагов, для борьбы с различными бактериями, устойчивыми к медпрепаратам.
Другая команда ученых из Международного научно-исследовательского института животноводства, который тоже находится в Кении, разработала технологию на основе фагов, которая предотвращает заражение домашней птицы сальмонеллой. Команда из Питсбурского университета смогла накопить банк из 10000 бактериофагов против самых разных инфекций.

Сотрудники Кенийского медицинского исследовательского института обнаружили уже более 150 фагов, способных уничтожать бактерии, устойчивые к лекарственным препаратам
Более того, бактериофаги все чаще используются для лечения опасных инфекций. К примеру, в США, некоторых странах Европы, а также Австралии фаготерапия применяется в экстренных случаях, когда известно, что человек наверняка умрет из-за лекарственно устойчивых бактерий. Так команда из Питсбурского университета только за 2017 год вылечила при помощи фаготерапии 40 пациентов.
Перспективы фаготерапииНесмотря на то, что уже есть успешные примеры лечения смертельных болезней фагами, фаготерапия до конца не изучена. По своей природе фаги размножаются внутри бактериальных клеток, в результате чего их убивают. Но неизвестно, как быстро это происходит после введения тех или иных фагов пациенту.
То есть разные фаги могут вести себя по разному. Поэтому трудно рассчитать и отследить их дозировку на разных стадиях лечения болезни. При приеме же антибиотиков врачи знают точную дозу и время, необходимое для распада препарата в организме. Однако имеющиеся данные указывают на то, что даже высокие дозы фагов безопасны для человека. То есть, теоретически всегда можно принимать максимальную дозу, так как хуже от этого не станет.

Ученым во всем мире необходимо постоянно искать новые фаги
Как уже было сказано выше, бактериофаги очень “узкоспециализированы”. Это означает, что их придется постоянно искать. Однако ученые уже работают над изучением генома фагов. Возможно, в будущем удастся искусственно создавать фаги, которые смогут уничтожать более широкий спектр бактерий.
Исследователи также разрабатывают национальные и глобальные банки фагов, к которым врачи и ученые могут легко получить доступ. Однако до сих пор нет четкого механизма для идентификации, закупки и массового производства фагов для терапии. Но самое главное, пока неизвестно как долго фаги будут эффективны, учитывая, что бактерии способны вырабатывать устойчивость к ним усточивость.
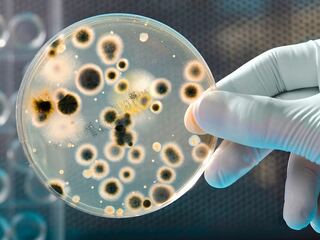
Бактерии быстро становятся устойчивыми к фагам
Как сообщают ученые, иногда бактерии за одну ночь вырабатывают устойчивость к фагам. Поэтому в настоящее время для предотвращения резистентности пациентам вводят смесь из четырех или пяти различных фагов. Но есть и хорошая новость — по мере появления устойчивых к микрофагам бактерий, появляются новые бактериофаги, которые способны их заражать и уничтожать. Эта особенность описывается как конструкция “замок-ключ”.
Не забудьте подписаться на наш Пульс Mail.ru, где вы найдете больше увлекательных и интересных материалов.
Учитывая низкие затраты на поиск новых фагов, ученые могут постоянно искать новые их виды по мере того, как бактерии вырабатывают к ним устойчивость. Сточные воды и другие среды, кишащие микробами, являются бесконечным источником новых фагов. Поэтому в отличие от антибиотиков, сама природа будет постоянно создавать новые бактериофаги, способные убивать бактерии.
Источник новости: hi-news.ru









